
ごあいさつ
- 死細胞のゴミ掃除屋マクロファージの免疫制御機構を解き明かす -
細胞の死骸を食べるマクロファージの働きに注目
生体には、不要になった細胞や有害な細胞を自ら死に向かわせて排除するという細胞死のプログラムが備わっている。アポトーシスと呼ばれるこの細胞死によって日々少しずつ細胞が入れ替わることで、私たちの身体は維持されているのだ。
しかし毎日約3000億個もの細胞が死んでいるにも関わらず、体内にその死骸はほとんど見当たらない。理由はマクロファージなどの食細胞が死骸を速やかに貪食しているためだ。田中正人教授は、アポトーシス研究において世界をリードしてきた研究者の一人であり、マクロファージのユニークな働きにも早くから関心を注いできた。
マクロファージが生きた細胞を決して食べず、死んだ細胞だけを貪食するメカニズムを明らかにしたのも、研究成果の一つだ。田中教授は大阪大学の長田重一教授の研究室で、死細胞に現れるシグナルを認識するマクロファージの遺伝子MFG-E8を同定し、死細胞とマクロファージを橋渡しして貪食を促す分子機構を解明した。「細胞死が起こると、死細胞の表面に特有のリン脂質が現れます。マクロファージはこの“Eat me signal”を特異的に認識する遺伝子MFG-E8を持っており、それがリン脂質と結合してマクロファージの貪食を促進することを確かめました」。
がん免疫を活性化するマクロファージを発見
最近の研究で、マクロファージは単に死細胞を貪食するだけでなく、それを分解・再利用することによって、さまざまな免疫応答を制御していることがわかってきたという。マクロファージの貪食現象がどのような役割を果たしているのか、田中教授は明らかにしようとしている。
その一つとして注目するのが、がんの死細胞ががんの増殖を抑制する現象だ。「放射線治療や化学療法でがん細胞を殺すと、死んだがん細胞を免疫系が認識してがんに対する免疫が活性化し、がんの増殖を抑えることが知られています。しかしどのような仕組みでがん免疫が誘導されるのか、詳しいメカニズムはわかっていませんでした」。
田中教授は、マウスを使った実験で、がんの死細胞を貪食してがん免疫を活性化するCD169陽性マクロファージを同定することに成功。CD169陽性マクロファージが死んだがん細胞を認識し、がん細胞を殺すメカニズムを解き明かした。「CD169陽性マクロファージは、リンパ節の外側で待ち構えていて、がんの死細胞を貪食します。その際、食べた死細胞に含まれるがん抗原を提示して、がんのキラー細胞である細胞傷害性T細胞を活性化させ、がん細胞を殺すという仕組みです」。田中教授はその後の研究で、CD169陽性マクロファージが多くの組織で免疫制御を司り、がんだけでなく、炎症性腸疾患や虚血性臓器障害などの病態に関与していることも確かめている。
炎症を抑えて組織の修復を促す免疫細胞の存在を初めて実証
最近の研究では、炎症や組織傷害の回復期に出現し、組織修復を促す新しい免疫細胞を発見している。
細菌感染や組織傷害を負うと、もともと組織に存在するマクロファージに加えて、骨髄からマクロファージの基になる血球細胞(単球)が供給され、炎症などの免疫応答を起こす。「炎症が起こった後、炎症を抑えて組織の修復を促すマクロファージや単球の由来については、二つの可能性が指摘されてきました」と田中教授。一つは、同一のマクロファージが炎症の誘導と炎症収束・組織修復の両方に働く可能性だ。しかし同じ細胞が急性期と回復期でどのように正反対の働きをするのかはわからなかった。一方、田中教授が考えたのは、炎症を起こすマクロファージとは別に、炎症を抑えるマクロファージの基(単球)が骨髄で産生される可能性だ。
それを確かめるために田中教授が着目したのは、Ym1というタンパク分子だった。Ym1は炎症収束や組織修復を担うマクロファージに発現することが報告されているため、これをマーカーとして利用しようと考えたのだ。そこでYm1を発現する細胞(Ym1陽性単球)を蛍光標識したマウスを作製し、追跡を試みた。
「全身炎症を引き起こすLPSというリポ多糖を投与したマウスのYm1陽性単球の動態を解析すると、LPSを投与してから炎症がピークを迎えるまでの2~24時間は、Ym1陽性単球数にほとんど変化はありませんでした。ところが炎症が収まり、回復していく48時間後、Ym1陽性単球の数が爆発的に増えたのです」。この細胞数の増加は、単球が産生される骨髄でも見られたことから、Ym1陽性単球は、炎症の回復期に骨髄で増産されたものだとわかる。このような組織を修復する単球の存在を証明したのは、田中教授の研究が初めてだった。つまり同じマクロファージが働きを変えるのではなく、急性期と回復期で骨髄から異なる細胞が産生されるという田中教授の仮説が裏づけられたわけだ。さらに教授は、大腸炎の腸管局所炎症モデルを用いた実験でも、Ym1陽性単球が同様の機能を果たすことを示す結果を得ている。
Ym1陽性単球を効率よく増やすことができれば、傷害を受けた臓器の修復を促進する治療薬を開発できるかもしれない。また反対に、がんなどの悪性腫瘍の組織修復プロセスを妨げられる可能性も出てくる。田中教授はこうしたさまざまな免疫制御機構を解明し、がんや自己免疫疾患の治療に役立つ創薬につなげようとしている。

田中正人
生命科学部 生命医科学科
免疫制御学研究室
教授 / 博士(医学)
腸管におけるCD169マクロファージの免疫染色像。
CD169マクロファージ(赤色)は、腸上皮細胞から少し離れた粘膜下層に局在しており、自己免疫疾患の一種である炎症性腸疾患の発症に重要な役割を担っている。
プロジェクト紹介
MISSION
”免疫細胞を味方につけて病気を治す”

田中 正人教授
研究概要
我々の体内には、たくさんの種類の免疫細胞がいて、体内に侵入した病原体を素早く感知し、これをできるだけ早く排除しようとします。この免疫細胞のおかけで、我々は健康を保つことができています。しかし、この免疫細胞が働きすぎて、炎症が強く起こってしまうと、それが自分自身の組織、細胞を傷つけることがあります。アンバランスな免疫応答は、がん、自己免疫疾患や感染症など様々な病気を悪化させることがあります。免疫細胞の働きを適切にコントロールする方法を見つけることができれば、難病と言われる様々な病気の画期的な治療法の開発につながります。免疫制御学研究室では、単球、マクロファージや、好中球と呼ばれる免疫細胞を自在にコントロールする方法を発見すべく、日夜研究を進めています。
研究内容
炎症を抑える単球に関する研究
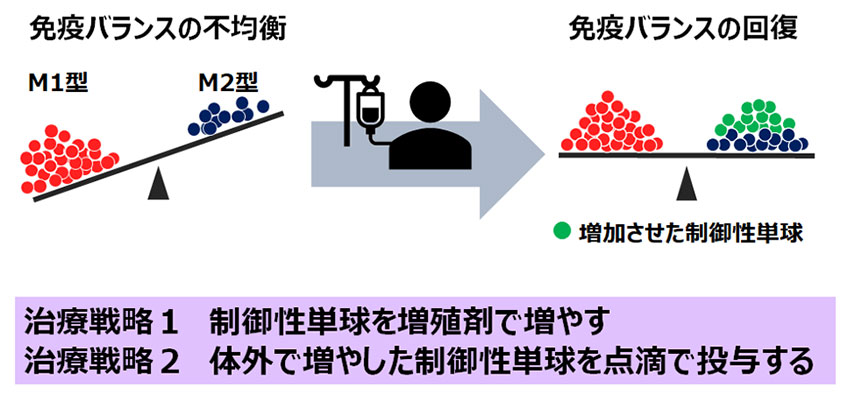
最近、我々は、炎症を誘導する一般的な単球とは異なる、炎症を抑える力をもつ新しい単球細胞を発見しました。この細胞は、健康な時や、炎症の急性期にはほとんど存在しませんが、炎症の終わりごろになると骨髄で盛んに作られ、血液中に送りだされます。炎症を抑え、傷ついた組織の修復を助けることにちなんで、この細胞を「制御性単球」と名づけました。我々は、制御性単球の働きを強化することで、炎症性腸疾患など、さまざまな炎症疾患の治療に役立てたいと考えています。たとえば、炎症がひどくなる時期に、制御性単球の増殖剤を投与すれば、回復を速めることができるかもしれません。患者さんの制御性単球を体外で増やして、点滴で患者さん自身に投与するなどの方法も考えられます。
非アルコール性脂肪肝炎の進行に関わるマクロファージの研究
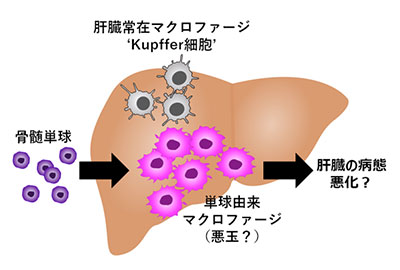
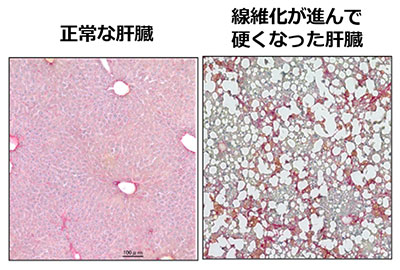
過度の飲酒は肝臓病の原因として有名です。しかし、お酒をあまり飲まない方の脂肪肝でも、アルコール性脂肪肝と同じように、肝炎さらには肝硬変に進行することがあります。最近、その病態の悪化に、マクロファージと呼ばれる免疫細胞が深く関わることが分かってきました。悪さをするマクロファージの働きを抑えれば、肝臓の病気が良くなりそうなものですが、肝臓には役割のちがう複数のマクロファージが混在しており、これまでのところ悪玉だけを狙い撃ちする方法がみつかっていません。我々は、病態の悪化に関わる悪玉マクロファージの産生を止める、あるいは、その働きを抑えることで、肝臓病の悪化を食い止める方法を開発することを目指しています。
好中球細胞外トラップとその制御に関する研究
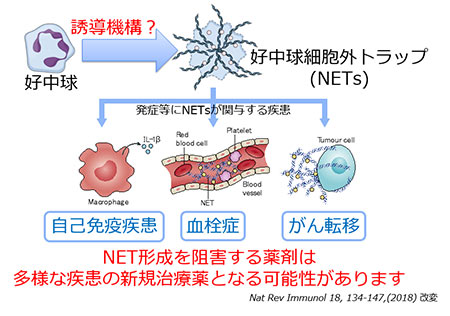
免疫細胞の一種である好中球は、2つの感染防御防御システムを有しています。1つは細菌などを食べて消化分解する貪食であり、もう1つは好中球細胞外トラップ(NETs)です。NETsは自身のクロマチンを細胞外に放出して形成される網状の構造物です。NETsは、好中球内顆粒に含まれる様々な抗菌物質から構成され、病原体の捕獲殺菌に寄与することが報告されています。一方で、NET形成が自己免疫疾患の発症や悪化、血栓症、がん転移の促進に加え、最近では、新型コロナウイルス感染症の重症化にも関与する可能性が指摘されています。我々の研究室では、NETsがどのようなメカニズムで誘導されるのか研究を行うと共に、NET形成を阻害できる薬剤の開発を通して疾患の治療を行うことを目標としています。
メンバー

教授 田中 正人
mtanaka(a)toyaku.ac.jp
准教授 四元 聡志
yotumoto(a)toyaku.ac.jp
助教 池田 直輝
ikedan(a)toyaku.ac.jp
※メールアドレスの(a)は@に置き換えて下さい
| 客員教授 | 浅野 謙一 |
|---|
| 連携研究員 | 小川 慶 |
|---|
| 実験補助員 | 大川 和佳子 / 西口 隆雄 |
|---|
| 秘書 | 勝呂 啓子 |
|---|
| D2 | 長田 優也 |
|---|
| M2 | 小原 英樹 / 瀬戸口 碧海 |
|---|
| M1 | 宿谷 日菜乃 / 川又 悠太郎 / 小松 文乃 / 上村 千桃 |
|---|
| 卒業研究生 | 白澤 侑美夏 / 永嶋 拓真 / 松永 唯希 / 木村 真大朗 / 倉橋 直希 / 佐藤 正治 / 中島 可心 / 堀池 咲良 / 町田 彩寧/ 松本 裕香 / 茂木 佳奈 / 渡辺 洋子 |
|---|
業績
Publication List 教授 田中 正人
2018
Shinde PV, Xu HC, Maney SK, Kloetgen A, Namineni S, Zhuang Y, Honke N, Shaabani N, Bellora N, Doerrenberg M, Trilling M, Pozdeev VI, van Rooijen N, Scheu S, Pfeffer K, Crocker PR, Tanaka M, Duggimpudi S, Knolle P, Heikenwalder M, Ruland J, Mak TW, Brenner D, Pandyra AA, Hoell JI, Borkhardt A, Haussinger D, Lang KS, Lang PA. Tumor Necrosis Factor-Mediated Survival of CD169(+) Cells Promotes Immune Activation during Vesicular Stomatitis Virus Infection. J Virol 92; 2018. 
Kikuchi K, Iida M, Ikeda N, Moriyama S, Hamada M, Takahashi S, Kitamura H, Watanabe T, Hasegawa Y, Hase K, Fukuhara T, Sato H, Kobayashi EH, Suzuki T, Yamamoto M, Tanaka M, Asano K. Macrophages Switch Their Phenotype by Regulating Maf Expression during Different Phases of Inflammation. J Immunol 201; 635-51, 2018. 
Ikeda N, Asano K, Kikuchi K, Uchida Y, Ikegami H, Takagi R, Yotsumoto S, Shibuya T, Makino-Okamura C, Fukuyama H, Watanabe T, Ohmuraya M, Araki K, Nishitai G, Tanaka M. Emergence of immunoregulatory Ym1(+)Ly6C(hi) monocytes during recovery phase of tissue injury. Sci Immunol 3; 2018. 
Deguchi Y, Nishina T, Asano K, Ohmuraya M, Nakagawa Y, Nakagata N, Sakuma T, Yamamoto T, Araki K, Mikami T, Tanaka M, Nakano H. Generation of and characterization of anti-IL-11 antibodies using newly established Il11-deficient mice. Biochem Biophys Res Commun 505; 453-9, 2018. 
2017
Yotsumoto S, Muroi Y, Chiba T, Ohmura R, Yoneyama M, Magarisawa M, Dodo K, Terayama N, Sodeoka M, Aoyagi R, Arita M, Arakawa S, Shimizu S, Tanaka M. Hyperoxidation of ether-linked phospholipids accelerates neutrophil extracellular trap formation. Sci Rep 7; 16026, 2017. 
Wang D, Li Q, Yang Y, Hao S, Han X, Song J, Yin Y, Li X, Tanaka M, Qiu CH. Macrophage Subset Expressing CD169 in Peritoneal Cavity-Regulated Mucosal Inflammation Together with Lower Levels of CCL22. Inflammation 40; 1191-203, 2017. 
Piao X, Yamazaki S, Komazawa-Sakon S, Miyake S, Nakabayashi O, Kurosawa T, Mikami T, Tanaka M, Van Rooijen N, Ohmuraya M, Oikawa A, Kojima Y, Kakuta S, Uchiyama Y, Tanaka M, Nakano H. Depletion of myeloid cells exacerbates hepatitis and induces an aberrant increase in histone H3 in mouse serum. Hepatology 65; 237-52, 2017. 
Perez OA, Yeung ST, Vera-Licona P, Romagnoli PA, Samji T, Ural BB, Maher L, Tanaka M, Khanna KM. CD169(+) macrophages orchestrate innate immune responses by regulating bacterial localization in the spleen. Sci Immunol 2; eaah5520, 2017. 
Li Q, Wang D, Hao S, Han X, Xia Y, Li X, Chen Y, Tanaka M, Qiu CH. CD169 Expressing Macrophage, a Key Subset in Mesenteric Lymph Nodes Promotes Mucosal Inflammation in Dextran Sulfate Sodium-Induced Colitis. Front Immunol 8; 669, 2017. 
Itoh M, Suganami T, Kato H, Kanai S, Shirakawa I, Sakai T, Goto T, Asakawa M, Hidaka I, Sakugawa H, Ohnishi K, Komohara Y, Asano K, Sakaida I, Tanaka M, Ogawa Y. CD11c+ resident macrophages drive hepatocyte death-triggered liver fibrosis in a murine model of nonalcoholic steatohepatitis. JCI Insight 2; 2017. 
Arai Y, Takahashi D, Asano K, Tanaka M, Oda M, Ko SBH, Ko MSH, Mandai S, Nomura N, Rai T, Uchida S, Sohara E. Salt suppresses IFNgamma inducible chemokines through the IFNgamma-JAK1-STAT1 signaling pathway in proximal tubular cells. Sci Rep 7; 46580, 2017. 
2016
Matsushita N, Suzuki M, Ikebe E, Nagashima S, Inatome R, Asano K, Tanaka M, Matsushita M, Kondo E, Iha H, Yanagi S.‘Regulation of B cell differentiation by the ubiquitin-binding protein TAX1BP1.’Scientific Reports. 2016 Aug 12;6:31266. doi: 10.1038/srep31266. 
Yoshida T, Tsujioka M, Honda S, Tanaka M, Shimizu S. Autophagy suppresses cell migration by degrading GEF-H1, a RhoA GEF. Oncotarget. 2016 Jun 7;7(23):34420-9. doi: 10.18632/oncotarget.8883 
2015
Tanaka M, Nishitai G. Immune Regulation by Dead Cell Clearance.Curr Top Microbiol Immunol. 2015 Aug 18. 
Karasawa K, Asano K, Moriyama S, Ushiki M, Monya M, Iida M, Kuboki E, Yagita H, Uchida K, Nitta K, and Tanaka M. ‘Vascular-resident CD169-Positive Monocytes and macrophages Control Neutrophil Accumulation in the Kidney with Ischemia-reperfusion Injury.’ Journal of American Society of Nephrology. 26:896-906, 2015. doi: 10.1681/ASN.2014020195. 
Motomura Y, Kanno S, Asano K, Tanaka M, Hasegawa Y, Katagiri H, Saito T, Hara H, Nishio H, Hara T, Yamasaki S. ‘Identification of Pathogenic Cardiac CD11c+ Macrophages in Nod1-Mediated Acute Coronary Arteritis.’ Arterioscler Thromb Vasc Biol. 35(6):1423-33, 2015. doi: 10.1161/ATVBAHA.114.304846.

Inoue H, Matsuzaki Y, Tanaka A, Hosoi K, Ichimura K, Arasaki K, Wakana Y, Asano K, Tanaka M, Okuzaki D, Yamamoto A, Tani K, Tagaya M. ‘γ-SNAP stimulates disassembly of endosomal SNARE complexes and regulates endocytic trafficking pathways.’ J Cell Sci.128(15):2781-94, 2015. doi: 10.1242/jcs.158634. 
Asano K, Takahashi N, Ushiki M, Monya M, Aihara F, Kuboki E, Moriyama S, Iida M, Kitamura H, Qiu CH, Watanabe T, Tanaka M. ‘Intestinal CD169(+) macrophages initiate mucosal inflammation by secreting CCL8 that recruits inflammatory monocytes.’ Nat Commun. 21;6:7802, 2015.doi: 10.1038/ncomms8802. 
2014
Yonekawa, A., Saijo, S., Hoshino, Y., Miyake, Y., Ishikawa, E., Suzukawa, M., Inoue, H., Tanaka, M., Yoneyama, M., Oh-Hora, M., Akashi, K., and Yamasaki, S. Dectin-2 Is a Direct Receptor for Mannose-Capped Lipoarabinomannan of Mycobacteria. Immunity. 41(3):402-13.2014 
Taguchi K, Okada A, Kitamura H, Yasui T, Naik T, Hamamoto S, Ando R, Mizuno K, Kawai N, Tozawa K, Asano K, Tanaka M, Miyoshi I, Kohri K. Colony-Stimulating Factor-1 Signaling Suppresses Renal Crystal Formation. J Am Soc Nephrol. 25(8) : 1680-1697, 2014. Published online before print February 27, 2014, doi: 10.1681/ASN.2013060675 
Ravishankar B, Shinde R, Liu H, Chaudhary K, Bradley J, P. Lemos H, Chandler P, Tanaka M, Munn DH, Mellor AL, McGaha L, Marginal zone CD169+ macrophages coordinate apoptotic cell-driven cellular recruitment and tolerance. Proc Natl Acad Sci USA. 111(11):4215-4220, 2014. doi: 10.1073/pnas.1320924111. Epub 2014 Mar 3. Proceedings of the National Academy of Sciences of the United States of America. 
2013
Hashimoto D, Chow A, Noizat C, Teo P, Beasley MB, Leboeuf M, Becker CD, See P, Price J, Lucas D, Greter M, Mortha A, Boyer SW, Forsberg EC, Tanaka M, van Rooijen N, Garcia-Sastre A, Stanley ER, Ginhoux F, Frenette PS, Merad M. Tissue-Resident Macrophages Self-Maintain Locally throughout Adult Life with Minimal Contribution from Circulating Monocytes. Immunity, 38: 792-804, 2013. . doi: 10.1016/j.immuni.2013.04.004. 
Chow A, Huggins M, Ahmed J, Hashimoto D, Lucas D, Kunisaki Y, Pinho S, Leboeuf M, Noizat C, van Rooijen N, Tanaka M, Zhao ZJ, Bergman A, Merad M, Frenette PS. CD169(+) macrophages provide a niche promoting erythropoiesis under homeostasis and stress. Nat Med, 19: 429-436, 2013. 
2012
Ravishankar B, Liu H, Shinde R, Chandler P, Baban B, Tanaka M, Munn DH, Mellor AL, Karlsson MC, McGaha TL. Tolerance to apoptotic cells is regulated by indoleamine 2,3-dioxygenase. Proc Natl Acad Sci U S A, 109: 3909-3914, 2012. 
Mizukami S, Kajiwara C, Tanaka M, Kaisho T, Udono H. Differential MyD88/IRAK4 requirements for cross-priming and tumor rejection induced by heat shock protein 70-model antigen fusion protein. Cancer Sci, 103: 851-859, 2012. 
2011
Muppidi JR, Arnon TI, Bronevetsky Y, Veerapen N, Tanaka M, Besra GS, Cyster JG. Cannabinoid receptor 2 positions and retains marginal zone B cells within the splenic marginal zone. J Exp Med, 208: 1941-1948, 2011. 
Honke N, Shaabani N, Cadeddu G, Sorg UR, Zhang DE, Trilling M, Klingel K, Sauter M, Kandolf R, Gailus N, van Rooijen N, Burkart C, Baldus SE, Grusdat M, Lohning M, Hengel H, Pfeffer K, Tanaka M, Haussinger D, Recher M, Lang PA, Lang KS. Enforced viral replication activates adaptive immunity and is essential for the control of a cytopathic virus. Nat Immunol, 13: 51-57, 2011. 
Chow A, Lucas D, Hidalgo A, Mendez-Ferrer S, Hashimoto D, Scheiermann C, Battista M, Leboeuf M, Prophete C, van Rooijen N, Tanaka M, Merad M, Frenette PS. Bone marrow CD169+ macrophages promote the retention of hematopoietic stem and progenitor cells in the mesenchymal stem cell niche. J Exp Med, 208: 261-271, 2011. 
Asano K, Nabeyama A, Miyake Y, Qiu CH, Kurita A, Tomura M, Kanagawa O, Fujii S, Tanaka M. CD169-Positive Macrophages Dominate Antitumor Immunity by Crosspresenting Dead Cell-Associated Antigens. Immunity, 34: 85-95, 2011. 
2010
Tanaka M, Asano K, Qiu CH. Immune regulation by apoptotic cell clearance. Ann N Y Acad Sci, 1209: 37-42, 2010. 
Nabeyama A, Kurita A, Asano K, Miyake Y, Yasuda T, Miura I, Nishitai G, Arakawa S, Shimizu S, Wakana S, Yoshida H, Tanaka M. xCT deficiency accelerates chemically induced tumorigenesis. Proc Natl Acad Sci U S A, 107: 6436-6441, 2010. 
2009
Tomura M, Mori YS, Watanabe R, Tanaka M, Miyawaki A, Kanagawa O. Time-lapse observation of cellular function with fluorescent probe reveals novel CTL-target cell interactions. Int Immunol, 21: 1145-1150, 2009. 
Qiu CH, Miyake Y, Kaise H, Kitamura H, Ohara O, Tanaka M. Novel subset of CD8{alpha}+ dendritic cells localized in the marginal zone is responsible for tolerance to cell-associated antigens. J Immunol, 182: 4127-4136, 2009. 
2008
Tanaka M, Miyake Y, Asano K. Maintenance of self-tolerance by apoptotic cell clearance. Front Biosci, 13: 6043-6049, 2008. 
2007
Witasp E, Uthaisang W, Elenstrom-Magnusson C, Hanayama R, Tanaka M, Nagata S, Orrenius S, Fadeel B. Bridge over troubled water: milk fat globule epidermal growth factor 8 promotes human monocyte-derived macrophage clearance of non-blebbing phosphatidylserine-positive target cells. Cell Death Differ, 14: 1063-1065, 2007. 
Tanaka M,Miyake Y. Apoptotic cell clearance and autoimmune disorder. Curr Med Chem, 14: 2892-2897, 2007. 
Miyake Y, Kaise H, Isono K, Koseki H, Kohno K, Tanaka M. Protective Role of Macrophages in Noninflammatory Lung Injury Caused by Selective Ablation of Alveolar Epithelial Type II Cells. J Immunol, 178: 5001-5009, 2007. 
Miyake Y, Asano K, Kaise H, Uemura M, Nakayama M, Tanaka M. Critical role of macrophages in the marginal zone in the suppression of immune responses to apoptotic cell-associated antigens. J Clin Invest 117: 2268-2278, 2007. 
Hijikata A, Kitamura H, Kimura Y, Yokoyama R, Aiba Y, Bao Y, Fujita S, Hase K, Hori S, Ishii Y, Kanagawa O, Kawamoto H, Kawano K, Koseki H, Kubo M, Kurita-Miki A, Kurosaki T, Masuda K, Nakata M, Oboki K, Ohno H, Okamoto M, Okayama Y, J OW, Saito H, Saito T, Sakuma M, Sato K, Sato K, Seino K, Setoguchi R, Tamura Y, Tanaka M, Taniguchi M, Taniuchi I, Teng A, Watanabe T, Watarai H, Yamasaki S, Ohara O. Construction of an open-access database that integrates cross-reference information from the transcriptome and proteome of immune cells. Bioinformatics, 23: 2934-2941, 2007. 
2006
Nakaya M, Tanaka M, Okabe Y, Hanayama R, Nagata S. Opposite effects of rho family GTPases on engulfment of apoptotic cells by macrophages. J Biol Chem, 281: 8836-8842, 2006. 
2005
Tanaka M. Apoptotic cell clearance by phagocytes. International Congress Series 1285, 55-59, 2005.
2004
Miyasaka K, Hanayama R, Tanaka M, Nagata S. Expression of milk fat globule epidermal growth factor 8 in immature dendritic cells for engulfment of apoptotic cells. Eur J Immunol, 34: 1414-1422, 2004. 
Hanayama R, Tanaka M, Miyasaka K, Aozasa K, Koike M, Uchiyama Y, Nagata S. Autoimmune Disease and Impaired Uptake of Apoptotic Cells in MFG-E8-Deficient Mice. Science, 304: 1147-1150, 2004. 
Hanayama R, Tanaka M, Miwa K, Nagata S. Expression of Developmental Endothelial Locus-1 in a Subset of Macrophages for Engulfment of Apoptotic Cells. J Immunol, 172: 3876-3882, 2004. 
Asano K, Miwa M, Miwa K, Hanayama R, Nagase H, Nagata S, Tanaka M. Masking of phosphatidylserine inhibits apoptotic cell engulfment and induces autoantibody production in mice. J Exp Med, 200: 459-467, 2004. 
2003
Tada K, Tanaka M, Hanayama R, Miwa K, Shinohara A, Iwamatsu A, Nagata S. Tethering of Apoptotic Cells to Phagocytes through Binding of CD47 to Src Homology 2 Domain-Bearing Protein Tyrosine Phosphatase Substrate-1. J Immunol, 171: 5718-5726, 2003. 
Nagase H, Fukuyama H, Tanaka M, Kawane K, Nagata S. Mutually regulated expression of caspase-activated DNase and its inhibitor for apoptotic DNA fragmentation. Cell Death Differ, 10: 142-143, 2003. 
2002
Hanayama R, Tanaka M, Miwa K, Shinohara A, Iwamatsu A, Nagata S. Identification of a factor that links apoptotic cells to phagocytes. Nature, 417: 182-187, 2002. 
2001
Shudo K, Kinoshita K, Imamura R, Fan H, Hasumoto K, Tanaka M, Nagata S, Suda T. The membrane-bound but not the soluble form of human Fas ligand is responsible for its inflammatory activity. Eur J Immunol, 31: 2504-2511, 2001. 
Itai T, Tanaka M, Nagata S. Processing of tumor necrosis factor by the membrane-bound TNF-alpha- converting enzyme, but not its truncated soluble form. Eur J Biochem, 268: 2074-2082., 2001. 
2000
McIlroy D, Tanaka M, Sakahira H, Fukuyama H, Suzuki M, Yamamura K, Ohsawa Y, Uchiyama Y, Nagata S. An auxiliary mode of apoptotic DNA fragmentation provided by phagocytes. Genes Dev, 14: 549-558, 2000. 
1999
Tanaka M, Fuentes ME, Yamaguchi K, Durnin MH, Dalrymple SA, Hardy KL, Goeddel DV. Embryonic lethality, liver degeneration, and impaired NF-kappaB activation in IKK-beta-deficient mice. Immunity, 10: 421-429, 1999. 
Cao Z, Tanaka M, Regnier C, Rothe M, Yamit-hezi A, Woronicz JD, Fuentes ME, Durnin MH, Dalrymple SA, Goeddel DV. NF-kappa B activation by tumor necrosis factor and interleukin-1. Cold Spring Harb Symp Quant Biol, 64: 473-483, 1999. 
1998
Yagi T, Sugimoto A, Tanaka M, Nagata S, Yasuda S, Yagita H, Kuriyama T, Takemori T, Tsunetsugu-Yokota Y. Fas/FasL interaction is not involved in apoptosis of activated CD4+ T cells upon HIV-1 infection in vitro. J Acquir Immune Defic Syndr Hum Retrovirol, 18: 307-315, 1998. 
Toyozaki T, Hiroe M, Tanaka M, Nagata S, Ohwada H, Marumo F. Levels of soluble Fas ligand in myocarditis. Am J Cardiol, 82: 246-248, 1998. 
Tanaka M, Itai T, Adachi M, Nagata S. Downregulation of Fas ligand by shedding. Nat Med, 4: 31-36, 1998. 
Mizuki M, Ueda S, Tagawa S, Shibayama H, Nishimori Y, Shibano M, Asada H, Tanaka M, Nagata S, Koudera U, Suzuki K, Machii T, Ohsawa M, Aozasa K, Kitani T, Kanakura Y. Natural killer cell-derived large granular lymphocyte lymphoma of lung developed in a patient with hypersensitivity to mosquito bites and reactivated Epstein-Barr virus infection. Am J Hematol, 59: 309-315, 1998. 
Hashimoto H, Tanaka M, Suda T, Tomita T, Hayashida K, Takeuchi E, Kaneko M, Takano H, Nagata S, Ochi T. Soluble Fas ligand in the joints of patients with rheumatoid arthritis and osteoarthritis. Arthritis Rheum, 41: 657-662, 1998. 
Adachi S, Ito H, Tamamori M, Tanaka M, Marumo F, Hiroe M. Skeletal and smooth muscle alpha-actin mRNA in endomyocardial biopsy samples of dilated cardiomyopathy patients. Life Sci, 63: 1779-1791, 1998. 
1997
Tanaka M, Suda T, Yatomi T, Nakamura N, Nagata S. Lethal effect of recombinant human Fas ligand in mice pretreated with Propionibacterium acnes. J Immunol, 158: 2303-2309, 1997. 
Suda T, Hashimoto H, Tanaka M, Ochi T, Nagata S. Membrane Fas ligand kills human peripheral blood T lymphocytes, and soluble Fas ligand blocks the killing. J Exp Med, 186: 2045-2050, 1997. 
Ertel W, Keel M, Stocker R, Imhof HG, Leist M, Steckholzer U, Tanaka M, Trentz O, Nagata S. Detectable concentrations of Fas ligand in cerebrospinal fluid after severe head injury. J Neuroimmunol, 80: 93-96, 1997. 
Bahr GM, Capron A, Dewulf J, Nagata S, Tanaka M, Bourez JM, Mouton Y. Elevated serum level of Fas ligand correlates with the asymptomatic stage of human immunodeficiency virus infection. Blood, 90: 896-898, 1997. 
1996
Tanaka M, Suda T, Haze K, Nakamura N, Sato K, Kimura F, Motoyoshi K, Mizuki M, Tagawa S, Ohga S, Hatake K, Drummond AH, Nagata S. Fas ligand in human serum. Nat Med, 2: 317-322, 1996. 
Takeda K, Yu ZX, Nishikawa T, Tanaka M, Hosoda S, Ferrans VJ, Kasajima T. Apoptosis and DNA fragmentation in the bulbus cordis of the developing rat heart. J Mol Cell Cardiol, 28: 209-215, 1996. 
Takahashi T, Tanaka M, Ogasawara J, Suda T, Murakami H, Nagata S. Swapping between Fas and granulocyte colony-stimulating factor receptor. J Biol Chem, 271: 17555-17560, 1996. 
Suda T, Tanaka M, Miwa K, Nagata S. Apoptosis of mouse naive T cells induced by recombinant soluble Fas ligand and activation-induced resistance to Fas ligand. J Immunol, 157: 3918-3924, 1996. 
Sato K, Kimura F, Nakamura Y, Murakami H, Yoshida M, Tanaka M, Nagata S, Kanatani Y, Wakimoto N, Nagata N, Motoyoshi K. An aggressive nasal lymphoma accompanied by high levels of soluble Fas ligand. Br J Haematol, 94: 379-382, 1996. 
Ito H, Adachi S, Tamamori M, Fujisaki H, Tanaka M, Lin M, Akimoto H, Marumo F, Hiroe M. Mild hypoxia induces hypertrophy of cultured neonatal rat cardiomyocytes: a possible endogenous endothelin-1-mediated mechanism. J Mol Cell Cardiol, 28: 1271-1277, 1996. 
Estaquier J, Tanaka M, Suda T, Nagata S, Golstein P, Ameisen JC. Fas-mediated apoptosis of CD4+ and CD8+ T cells from human immunodeficiency virus-infected persons: differential in vitro preventive effect of cytokines and protease antagonists. Blood, 87: 4959-4966, 1996. 
Akimoto H, Ito H, Tanaka M, Adachi S, Hata M, Lin M, Fujisaki H, Marumo F, Hiroe M. Heparin and heparan sulfate block angiotensin II-induced hypertrophy in cultured neonatal rat cardiomyocytes. A possible role of intrinsic heparin-like molecules in regulation of cardiomyocyte hypertrophy. Circulation, 93: 810-816, 1996. 
1995
Tanaka M, Suda T, Takahashi T, Nagata S. Expression of the functional soluble form of human fas ligand in activated lymphocytes. Embo J, 14: 1129-1135, 1995. 
Tanaka M, Hiroe M, Ito H, Nishikawa T, Adachi S, Aonuma K, Marumo F. Differential localization of atrial natriuretic peptide and skeletal alpha-actin messenger RNAs in left ventricular myocytes of patients with dilated cardiomyopathy. J Am Coll Cardiol, 26: 85-92, 1995. 
Fujisaki H, Ito H, Hirata Y, Tanaka M, Hata M, Lin M, Adachi S, Akimoto H, Marumo F, Hiroe M. Natriuretic peptides inhibit angiotensin II-induced proliferation of rat cardiac fibroblasts by blocking endothelin-1 gene expression. J Clin Invest, 96: 1059-1065, 1995. 
Adachi S, Ito H, Ohta Y, Tanaka M, Ishiyama S, Nagata M, Toyozaki T, Hirata Y, Marumo F, Hiroe M. Distribution of mRNAs for natriuretic peptides in RV hypertrophy after pulmonary arterial banding. Am J Physiol, 268: H162-169, 1995. 
1994
Tanaka M, Ito H, Adachi S, Akimoto H, Nishikawa T, Kasajima T, Marumo F, Hiroe M. Hypoxia induces apoptosis with enhanced expression of Fas antigen messenger RNA in cultured neonatal rat cardiomyocytes. Circ Res, 75: 426-433, 1994. 
Tanaka M, Hiroe M, Nishikawa T, Sato T, Marumo F. Cellular localization and structural characterization of natriuretic peptide-expressing ventricular myocytes from patients with dilated cardiomyopathy. J Histochem Cytochem, 42: 1207-1214, 1994. 
Takahashi T, Tanaka M, Inazawa J, Abe T, Suda T, Nagata S. Human Fas ligand: gene structure, chromosomal location and species specificity. Int Immunol, 6: 1567-1574, 1994. 
Takahashi T, Tanaka M, Brannan CI, Jenkins NA, Copeland NG, Suda T, Nagata S. Generalized lymphoproliferative disease in mice, caused by a point mutation in the Fas ligand. Cell, 76: 969-976, 1994. 
Adachi S, Ito H, Akimoto H, Tanaka M, Fujisaki H, Marumo F, Hiroe M. Insulin-like growth factor-II induces hypertrophy with increased expression of muscle specific genes in cultured rat cardiomyocytes. J Mol Cell Cardiol, 26: 789-795, 1994. 
1993
Kawai M, Nishikawa T, Tanaka M, Ando A, Kasajima T, Higa T, Tanikawa T, Kagawa M, Momma K. An autopsied case of Williams syndrome complicated by moyamoya disease. Acta Paediatr Jpn, 35: 63-67, 1993. 
Ito H, Hirata Y, Adachi S, Tanaka M, Tsujino M, Koike A, Nogami A, Murumo F, Hiroe M. Endothelin-1 is an autocrine/paracrine factor in the mechanism of angiotensin II-induced hypertrophy in cultured rat cardiomyocytes. J Clin Invest, 92: 398-403, 1993. 
著書
Tanaka M, Nishitai G. Immune Regulation by Dead Cell Clearance. Curr Top Microbiol Immunol 403; 171-83, 2017.
Nagata S, Tanaka M. Programmed cell death and the immune system. Nat Rev Immunol 17; 333-40, 2017.
Kenichi Asano and Masato Tanaka‘Development of Sentinel-Cell Targeted Therapy for Inflammatory Bowel Diseases’Chronic Inflammation, Chapter 46, pp.617-626 DOI: 10.1007/978-4-431-56068-5_46
Nagata S, Tanaka M. Programmed cell death and the immune system. Nat Rev Immunol. 2017 May;17(5):333-340. doi: 10.1038/nri.2016.153. Epub 2017 Feb 6. Review.
邦文総説
浅野 謙一、田中 正人「死細胞貪食マクロファージ」 実験医学増刊Vol.34-No.7 2016, pp.1089-1094
西躰 元, 田中 正人「死細胞貪食マクロファージ」臨床免疫・アレルギー科 63:431-435(2015)
浅野 謙一、唐澤 一徳、田中 正人「CD169発現常在マクロファージによる組織恒常性維持と免疫制御」細胞工学 33:1261-1266(2014)
浅野 謙一、田中 正人「CD169陽性マクロファージの免疫制御機能」感染・炎症・免疫 41:26-34(2011)
浅野 謙一、田中 正人「死細胞の貪食異常と自己免疫疾患」実験医学26: 3019-3024(2008)
浅野 謙一、田中 正人「食細胞によるアポトーシス細胞の貪食異常と、自己免疫疾患」Molecular Medicine 41: 171-177(2005)
Publication List 准教授 四元 聡志
2018
Ikeda N, Asano K, Kikuchi K, Uchida Y, Ikegami H, Takagi R, Yotsumoto S, Shibuya T, Makino-Okamura C, Fukuyama H, Watanabe T, Ohmuraya M, Araki K, Nishitai G, Tanaka M. Emergence of immunoregulatory Ym1(+)Ly6C(hi) monocytes during recovery phase of tissue injury. Sci Immunol 3; 2018. 
2017
Yotsumoto S, Muroi Y, Chiba T, Ohmura R, Yoneyama M, Magarisawa M, Dodo K, Terayama N, Sodeoka M, Aoyagi R, Arita M, Arakawa S, Shimizu S, Tanaka M. Hyperoxidation of ether-linked phospholipids accelerates neutrophil extracellular trap formation. Sci Rep 7; 16026, 2017. 
Kawamura S, Onai N, Miya F, Sato T, Tsunoda T, Kurabayashi K, Yotsumoto S, Kuroda S, Takenaka K, Akashi K, Ohteki T.Identification of a Human Clonogenic Progenitor with Strict Monocyte Differentiation Potential: A Counterpart of Mouse cMoPs. Immunity. 2017 May 16;46(5):835-848. 
2016以前
Ohyagi H, Onai N, Sato T, Yotsumoto S, Liu J, Akiba H, Yagita H, Atarashi K, Honda K, Roers A, Müller W, Kurabayashi K, Hosoi-Amaike M., Takahashi N., Hirokawa M., Matsushima K., Sawada K. & Ohteki T. Monocyte-derived dendritic cells perform hemophagocytosis to fine-tune excessive immune responses. Immunity 39, p584-598. (2013). 
Sato T., Ikeda M., Yotsumoto S., Shimada Y., Higuchi T., Kobayashi H., Fukuda T., Ohashi T., Suda T. & Ohteki T. Novel interferon-based pre-transplantation conditioning in the treatment of a congenital metabolic disorder. Blood 121, p3267-3273. (2013). 
Yotsumoto S., Saegusa K. & Aramaki Y. Endosomal translocation of CpG-oligodeoxynucleotides inhibits DNA-PKcs-dependent IL-10 production in macrophages. J Immunol 180, p809-816 (2008). 
Saegusa K, Yotsumoto S., Kato S. & Aramaki Y. Phosphatidylinositol 3-kinase-mediated regulation of IL-10 and IL-12 production in macrophages stimulated with CpG oligodeoxynucleotide. Mol Immunol 44, p1323-1330. (2007). 
Yotsumoto S., Kakiuchi T. & Aramaki Y. Enhancement of IFN-gamma production for Th1-cell therapy using negatively charged liposomes containing phosphatidylserine. Vaccine 25, p5256-5262. (2007). 
Inoue J., Yotsumoto S., Sakamoto T., Tsuchiya S. & Aramaki Y. Changes in immune responses to mite antigen sensitized through barrier-disrupted skin with CpG-oligodeoxynucleotide in mice. Biol Pharm Bull 29, p385-387 (2006). 
Yoshida T., Oide N., Sakamoto T., Yotsumoto S., Negishi Y., Tsuchiya S. & Aramaki Y. Induction of cancer cell-specific apoptosis by folate-labeled cationic liposomes. J Control Release 111, p325-332. (2006). 
Inoue J., Yotsumoto S., Sakamoto T., Tsuchiya S. & Aramaki Y. Changes in immune responses to antigen applied to tape-stripped skin with CpG-oligodeoxynucleotide in mice. J Control Release 108, p294-305. (2005). 
Inoue J., otsumoto S., Sakamoto T., Tsuchiya S. & Aramaki Y. Changes in immune responses to antigen applied to tape-stripped skin with CpG-oligodeoxynucleotide in NC/Nga mice. Pharm Res 22, p1627-1633. (2005). 
Yotsumoto S., Kakiuchi T. & Aramaki Y. Negatively charged phospholipids suppress IFN-gamma production in T cells. Biochem Biophys Res Commun 338, p1719-1725. (2005). 
Yotsumoto S., Aramaki Y., Kakiuchi T. & Tsuchiya S. Induction of antigen-dependent interleukin-12 production by negatively charged liposomes encapsulating antigens. Vaccine 22, 3503-3509. (2004). 
Aramaki Y., Yotsumoto S., Watanabe H. & Tsuchiya S. NADPH-oxidase may contribute to IL-12 production in macrophages stimulated with CpG phosphorothioate oligodeoxynucleotides. Biol Pharm Bull 25, p351-355. (2002). 
総説・著書
四元聡志, 田中正人. 好中球細胞外トラップの誘導機構とその生理的および病理的意義. 臨床免疫・アレルギー科. 70巻3号p301. (2018)
四元聡志, 樗木俊聡. IL-15. 朝倉書店, 桂義元, 河本 宏, 小安重夫, 山村一彦 (編) 免疫の事典. p61. (2011).
横山 晴子, 四元 聡志, 坂本 宜俊, 新槇幸彦, 山田安彦. カレントトピックス2005 注射剤調剤; 第1章 注射剤調剤の推進に向けて.月刊薬事 臨時増刊. 47巻4号p549. (2005).




